Di dalam kebanyakan reaksi senyawa organik ada satu atau lebih ikatan kovalen yang putus. Oleh karena itu, mekanisme reaksi kimia organik dapat dibagi dalam tiga jenis dasar, tergantung pada bagaimana ikatan tersebut putus.
Jika suatu ikatan putus dalam mana kedua elektron kovalennya tetap pada satu bagian pecahan maka mekanisme disebut heterosiklik.
Di dalam reaksi heterosiklik, umumnya pereaksi yang membawa pasangan elektron ke substrat atau mengambil elektron dari substrat. Pereaksi yang membawa pasangan elektron disebut nukleofil dan reaksinya disebut nukleofilik. Pereaksi yang mengambil pasangan elektron disebut elektrofil dan reaksinya disebut elektrofilik.
tergantung pada reaktan mana yang ditandai sebagai substrat dan yang
mana sebagai pereaksi penyerang.\
1. Substitusi nukleofilik2. Substitusi elektrofilik
3. Substitusi radikal bebas
Apabila dikehendaki penambahan atom oksigen pada cincin aromatik diperlukan pendekatan alternatif lain, yaitu dengan menambahkan sinton RO- pada senyawa aromatik dengan suatu gugus pergi (a leaving group). Reaksi ini dikenal dengan nama reaksi substitusi nukleofilik terhadap senyawa aromatik.
Faktor-faktor yang mempengaruhi reaksi SN2
• Kekuatan relatif nukleofil : nukleofil yang bermuatan negatif lebih kuat dari nukleofil netral.
• Efek Sterik pada nukleofil : nukleofil dengan struktur yang lebih meruah akan terintangi ketika membentuk ikatan tunggal.
Reaksi Substitusi Aromatik Kedua
Untuk mengetahui mekanisme reaksi dari senyawa aromatik tersebut sangat berkaitan cepat atau tidaknya rekasi dari senyawa aromatik, bahkan bisa atau tidaknya suatu senyawa bereaksi. Suatu gugus yang melekat pada senyawa aromatik menentukan arah reaksi dan pengarah itulah yang akan berkaitan dengan laju dan kereaktifan suatu senyawa aromatik.
Gugus-gugus yang meningkatkan laju reaksi dinamakan gugus pengaktif sedangkan gugus yang memperlambat laju reaksi disebut gugus pendeaktif. Gugus-gugus yang termasuk kelompok pengarah orto-para sebagian bersifat pengaktif dan sebagian lainnya bersifat pendeaktif, sedangkan gugus-gugus pengarah meta semuanya termasuk dalam kelompok pendeaktif.
Gugus Pengarah Orto, Para (Aktivator)
Gugus pada cincin akan mengarahkan substituen yang baru masuk pada posisi orto, para atau meta sesuai dengan gugus mulanya. Gugus mula tersebut yang disebut sebagai penentu orientasi. Gugus yang merupakan activator kuat adalah gugus pengarah orto, para (adisi elektrofilik mengambil tempat pada posisi orto dan para bergantung pada activator).gugus metal ialah pengarah orto, para, karena reaksi ini dapat berlangsung melalui karbokation intermediet yang paling stabil. Sama halnya, semua gugus alkil adalah orto, para.
Suatu pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena. Dalam reaksi nitrobenzena, gugus nitronya tidak menambah kesetabilan intermedietnya. Malahan intermediet substitusi orto, atau para dan keadaan transisinya kurang stabil (karena energy yang tinggi), karena sebuah struktur resonansi mengandung muatan positif pada atom berdekatan
Substitusi ketiga
Jika dua substituen itu mengarahkan suatu gugus masuk ke satu posisi, maka posisi ini akan merupakan posisi utama dari substitusi ketiga.
Persamaan Hammett
Persamaan yang digunakan untuk menyatakan nilai efek elektronik yang dirumuskan oleh Hammet adalah sebagai berikut:
Persamaan ini menggambarkan pengaruh substituen polar posisi meta atau para terhadap sisi reaksi turunan benzena. Persamaan Hammet tidak berlaku untuk substituen pada posisi orto karena adanya efek sterik, dan juga terhadap turunan alifatik karenapelintiran rantai karbon dapat menimbulkan aksi sterik.
Permasalahan :
1. Unsur halogen merupakan gugus pendeaktif, tetapi kenapa termasuk dalam kelompok pengarah orto, para?
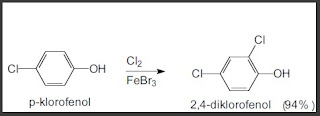
2.
dalam reaksi diatas, kenapa substituen Cl yang ditambahkan lebih memilih berada disamping gugus OH dibandingkan disamping gugus Cl?
3. Pada m-kloroanisola yang direaksikan dengan Cl2, produk apakah yang dapat dihasilkan dan dapatkah substituen Cl masuk diantara substituen pertama dan kedua?
4. Berdasarkan reaksi dibawah ini, jelaskan produk yang akan terbentuk berada pada posisi para, orto atau meta?
SUMBER:
Fessenden. 1986. Kimia Organik Jilid I. Jakarta : Erlangga
Firdaus. 2009. Kimia Organik Fisis 1. Makassar: UNHAS
http://staffnew.uny.ac.id/upload/130530945/pendidikan/buku-kimia-organik-sintesis.pdf












terima kasih atas materinya menurut saya terima kasih materinya vindi, menurut saya halogen memiliki efek induktif yang mampu menarik elektron yang kuat dai pada resonansi donor elektron yang lemah, sehingga halogen sebagai gugus pengarah orto-para
BalasHapusmenurut saya, halogen ini memiliki efek induktif yang akan mampu menarik elektron kuat dari pada resonansi donor elektron lemah, sehingga halogen ini sebagai gugus pengarah orto-para.
BalasHapus