Reaksi substitusi adalah
bentuk reaksi kimia, di mana suatu atom
dalam senyawa kimia digantikan dengan atom
lainnya.Di dalam reaksi heterosiklik, umumnya pereaksi
yang membawa pasangan elektron ke substrat atau mengambil elektron dari substrat.
Pereaksi yang membawa pasangan elektron disebut nukleofil dan reaksinya disebut
nukleofilik. Pereaksi yang mengambil pasangan elektron disebut elektrofil
dan reaksinya disebut elektrofilik. Di dalam suatu reaksi di mana
substrat terbelah, bagian yang tidak mengandung karbon biasa disebut gugus-pergi
(leaving group). Gugus-pergi yang membawa pergi elektron disebut nukleofugal,
dan gugus-pergi yang tanpa membawa elektron disebut elektrofugal.
dalam larutan asam alkohol dapat mengalami reaksi substitusi, tetapi
alkohol tidak mengalami substitusi pada larutan netral atau basa.
Substitusi bimolekul melibatkan tumbukan nukleofil dengan karbon substrat yang mengandung gugus pergi. Reaksi substitusi ini disebut sebagai reaksi SN2. Persamaan reaksi umum substitusi SN2
Gugus pergi
Gugus
pergi adalah substituen yang lepas dari substrat, yang berarti atom atau gugus
apa saja yang digeser dari ikatannya dengan atom karbon.
Pada reaksi
diatas, L merupakan leaving group atau
gugus pergi yang diakibatkan oleh adanya serangan dari nukleofil.
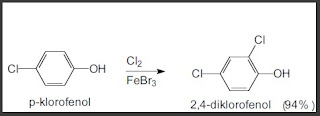
Alkil Halida
Dalam
reaksi substitusi alkil halida, halida disebut gugus pergi (leaving group). Ion
halida merupakan basa lemah sehingga ion halida berupakan
gugus pergi yang baik. Suatu Basa kuat, misalnya OH- bukan gugus
pergi yang baik.
Dalam reaksi substitusi alkil halida, ion iodida adalah halida yang
paling mudah digantikan, baru ion bromida dan kemudian klorida.
Jika gugus
karbonil mengikat sebuah gugus pergi yang bersifat elektronegatif maka
akan terjadi
pelepasan sebuah proton dan sebuah anion, sebagai contoh:
Gugus Tetanggga
Pada reaksi substitusi
nukleofilik, partisipasi gugus tetangga didefinisikan sebagai gugus yang
memberikan suatu reaksi intermediate yang baru pada pusat reaksi. Untuk reaksi
substitusi seperti dibawah, X sebagai gugus tetangga berperan dalam penyerangan
nukleofilik intramolekul sehingga melepaskan Y sebagai gugus pergi, yang
kemudian diikuti oleh substitusi intermolekul.
Jika suatu gugus
tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan
kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai “anchimeric
assistance”
Gugus tetangga dapat menggunakan
pasangan elektronnya untuk berinteraksi dengan sisi belakang atom karbon yang
menjalani substitusi, sehingga mencegah serangan dari nukleofilik, sehingga
nukleofilik hanya dapat bereaksi dengan atom karbon dari sisi depan, dan
produknya mengikuti konfigurasi awal.
Pertanyaan:
1. Kenapa
alkil halida tergolong dalam gugus pergi yang baik? Dan urutkan dari sifat
gugus pergi yang paling baik dari alkil halida
2. Dalam larutan
asam alkohol dapat mengalami reaksi substitusi, tetapi kenapa dalam larutan
netral atau basa tidak dapat mengalami reaksi substitusi?
3. Bagaimana mengetahui
peningkatan kecepatan reaksi dengan adanya partisipasi dari gugus tetangga?